Равновесие. Вещества вступают в химические реакции потому, что при этом уменьшается энергия системы, т.е. электронная конфигурация продуктов реакции оказывается энергетически более выгодной, чем конфигурация исходных реагентов. (Правда, есть еще один фактор - энтропийный;
см. также ТЕРМОДИНАМИКА.)
При большой разности энергий (т.е. большом различии в стабильности исходных реагентов и продуктов) реакция происходит мгновенно. Например, если кислород и водород смешать в определенном соотношении и смесь поджечь, то газы прореагируют мгновенно без остатка с образованием воды:
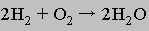
Молекула воды стабильнее, чем смесь водорода и кислорода, поскольку прочность двух связей О-Н больше, чем суммарная прочность связей Н-Н и О-О. Прочность связи определяется той энергией, которая выделяется при ее образовании.
См. также
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА. Если разность энергий исходных реагентов и конечных продуктов химической реакции невелика, то в реакционной смеси присутствуют в заметных количествах и те, и другие, причем по прошествии определенного времени между ними устанавливается равновесие. В качестве примера можно привести растворение уксусной кислоты в воде:
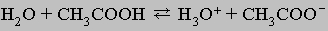
(Атомы водорода в группе СН3 соединены с атомом углерода прочными ковалентными связями и не являются кислотными.) Полной ионизации уксусной кислоты в этой реакции не происходит: когда примерно 1% ее молекул диссоциирует на ионы, скорость соединения последних с образованием исходных молекул становится равной скорости диссоциации и концентрация частиц в растворе перестает меняться. Устанавливается т.н. динамическое равновесие. Положение равновесия можно изменить (сдвинуть), добавляя или удаляя любое из веществ, участвующих в реакции. При этом равновесие сдвигается таким образом, чтобы эффект изменения концентрации был минимальным (принцип Ле Шателье).
Таким образом, добавление воды вызывает дополнительную ионизацию уксусной кислоты (поскольку при ионизации некоторое количество воды связывается в H3O+), а добавление ацетат-иона (СН3СОО-) дает обратный эффект. Каждая равновесная реакция характеризуется т.н. константой равновесия - величиной, равной отношению произведения концентраций продуктов к произведению концентраций исходных реагентов; при этом каждая из концентраций берется в степени, равной числу молекул данного типа, участвующих в реакции. Константа равновесия, как правило, не зависит от концентрации, но изменяется с температурой.
Кинетика. Скорости химических реакций сильно различаются. Например, смесь водорода и кислорода после того, как ее подожгут, буквально взрывается, а превращение алмаза в химически более устойчивую кристаллическую форму углерода, графит, происходит так медленно, что не завершается и за миллиарды лет. Скорость химических реакций определяется их механизмом. Многие реакции в действительности гораздо сложнее, чем это кажется из их суммарного уравнения. Так, оказалось, что разложение озона с образованием кислорода протекает в два этапа. На первом этапе диссоциирует одна молекула озона, при этом быстро достигается равновесие:
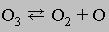
Второй этап гораздо более медленный, он и определяет скорость реакции:
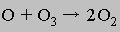
Сложение этих двух уравнений приводит к суммарному уравнению
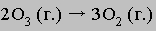
Не исключено, что впоследствии будут предложены другие механизмы, удовлетворяющие экспериментальным данным о скорости этой реакции. Наименьшая энергия, которой должны обладать взаимодействующие частицы для того, чтобы между ними началась химическая реакция, называется энергией активации. Как правило, чем она ниже, тем быстрее протекает реакция. Для протекания реакции большое значение имеет также энтропийный фактор.
Типы реакций. Реакции можно классифицировать, используя несколько схем, и каждая из них по-своему удобна. Здесь реакции разделены на три типа: ионные, в ходе которых ионы удаляются из зоны реакции путем образования нерастворимого, газообразного или ковалентно связанного продукта; окислительно-восстановительные, в которых происходит перемещение электронов; реакции (в том числе реакции между кислотой Льюиса и основанием Льюиса), сопровождающиеся перераспределением обобществленных электронов.
Ионные реакции. Простые ионные реакции без переноса электронов происходят, когда один из продуктов нерастворим (газ или твердое вещество) или является ковалентно связанным веществом, остающимся в растворе. Ионную реакцию, продукт которой - нерастворимое твердое вещество, можно представить в виде
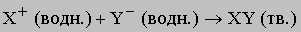
Сами ионы в ходе реакции не претерпели никаких изменений, но теперь они прочно удерживаются в кристаллической решетке. Для предсказания хода таких реакций важно знать растворимость участвующих в них веществ. Например, хлорид серебра плохо растворяется в воде, и можно сделать вывод, что реакция
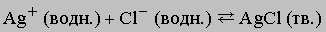
хотя и обратима, но равновесие сильно сдвинуто вправо. (Эту реакцию используют для обнаружения ионов хлора или серебра в растворе, а также для их количественного определения.
См. также ХИМИЯ АНАЛИТИЧЕСКАЯ.)
Ионы серебра могут находиться в составе любого из растворимых соединений: в виде нитрата, сульфата, ацетата и т.д.; ионы хлора могут быть компонентами таких солей, как соли натрия, калия, бария или алюминия. Таким образом, приведенное выше уравнение можно рассматривать как обобщенное представление реакции обменного разложения, когда два реагента разлагаются и обмениваются своими составляющими. Например, это могут быть такие реакции:
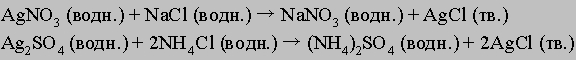
При образовании газообразного продукта вещество тоже выводится из зоны реакции. Этот тип ионной реакции можно представить в следующем виде:
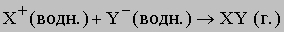
В данном случае ионы перестают существовать - из них образуются молекулы. В качестве примера можно привести растворение карбоната в кислом растворе. Вместе с образующимся газообразным диоксидом углерода из реакционной смеси уходят углерод и кислород:
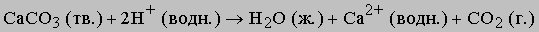
Реакции, в которых образуется ковалентно связанный (недиссоциирующий) продукт, можно представить следующим образом:
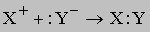
К этому типу относятся реакции нейтрализации. Когда соединение, которое диссоциирует с образованием ионов водорода (кислота), взаимодействует с основанием (источником гидроксильных ионов), образуется вода. В молекуле воды все атомы соединены ковалентными связями, поэтому реакция идет практически до конца (ее константа равновесия равна 10-14). Реакцию нейтрализации можно записать в виде
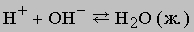
Приведем примеры реакций нейтрализации с участием сильной (HCl) и слабой (CH3COOH) кислот:
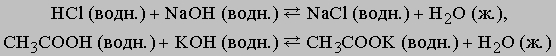
Сильные кислоты практически полностью диссоциируют в воде, высвобождая ионы водорода, слабые диссоциируют незначительно. Плохо диссоциируют и слабые основания. Ниже перечислены наиболее распространенные кислоты и основания. Отметим, что некоторые соединения обладают как кислотными, так и основными свойствами. Их называют амфотерными.
Слабые основания, представленные в таблице, не содержат ионов ОН-. Эти ионы образуются при взаимодействии с водой:
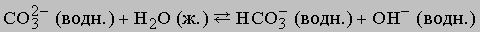
Поэтому раствор карбоната щелочной. Более общее определение кислот и оснований, которое используется и в случае неводных систем, например газов, было дано американским физикохимиком Г.Льюисом. Взаимодействие между льюисовыми кислотами и основаниями - это реакция между донором электронной пары, за счет которой образуется ковалентная связь (основание Льюиса), и акцептором этой пары (кислота Льюиса). В качестве примера можно привести следующие реакции:
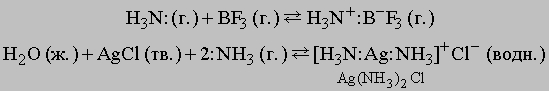
Окислительно-восстановительные реакции. Эти реакции сопровождаются переносом электронов между ионами, атомами или соединениями и могут быть представлены следующим образом:
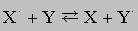
О соединении, которое отдает электроны, говорят, что оно окисляется; его называют восстановителем. Соединение, принимающее электроны, восстанавливается и является окислителем. Наиболее распространенные примеры окисления - реакции с участием элементного кислорода, например ржавление железа или горение любых горючих веществ. Уравнение горения магния имеет вид
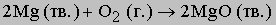
Примером окислительно-восстановительной реакции, протекающей без участия кислорода, является взаимодействие металлического натрия с газообразным хлором:
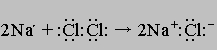
Этот способ написания уравнения показывает, что оба элемента по окончании реакции приобретают электронную конфигурацию инертного газа (на их внешних электронных оболочках - по 8 электронов). Направление этой реакции можно изменить на противоположное, приложив электрическое напряжение. Если пару электродов (графитовых стержней) погрузить в расплав хлорида натрия и соединить с источником постоянного тока, на отрицательном электроде произойдет реакция Na+ + e-> Na, а на положительном - 2Cl-> Cl2 + 2e- (здесь е- электрон). Этот процесс называют электролизом. (Устройство для проведения электролиза - электролитическая ячейка.)
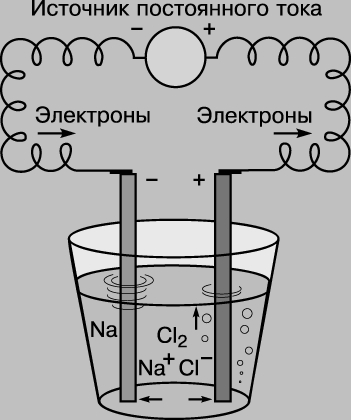
ЭЛЕКТРОЛИЗ РАСПЛАВА ХЛОРИДА НАТРИЯ, при котором ионы натрия Na+ собираются на катоде (отрицательном полюсе), а хлорид-ионы Cl- на аноде (положительном полюсе).
Процесс электролиза применяется для перезарядки свинцовых аккумуляторов и нанесения металлических покрытий (например, серебрение).
См. также
МЕТАЛЛОПОКРЫТИЯ. Окислительно-восстановительные реакции удобно представлять в виде суммы двух полуреакций, аналогичных тем, которые использовались для иллюстрации перемещения электронов между ионами натрия и хлора. Каждая полуреакция характеризуется электродным окислительно-восстановительным потенциалом, величиной которого определяется легкость передачи электронов. Этот потенциал зависит не только от природы соединения, но также от его концентрации, концентрации других веществ, вступающих в реакцию, и от температуры. Численные значения этих потенциалов обычно приводятся для конкретных условий: для растворенных веществ это эффективная концентрация 1 М; для газов - давление 1 атм (или парциальное давление 1 атм для каждого из газов, участвующих в реакции); для плохо растворимых твердых веществ и жидкостей - сами чистые твердые вещества и жидкости. В табл. 2 приведены значения стандартных потенциалов для некоторых распространенных полуреакций, представленных в виде реакций восстановления. Отметим, что для каждой полуреакции восстановленная форма вещества записывается в правой части уравнения, а окисленная - в левой. Паре ион водорода/газообразный водород приписан нулевой потенциал, потенциалы всех остальных пар измеряются по отношению к нему. Таким образом, пара с положительным потенциалом содержит лучший, чем ион водорода, окислитель, а пара, имеющая отрицательный потенциал, - лучший, чем газообразный водород, восстановитель. Величина окислительной или восстановительной способности вещества прямо пропорциональна стандартному потенциалу.
Таблицу 2 можно использовать для предсказания хода многих реакций. Нужно только помнить, что если полуреакцию записывают в противоположном направлении, чем это сделано в таблице, то ее потенциал следует брать с противоположным знаком. Обычно реакции идут до конца, если сумма потенциалов двух полуреакций (потенциал ячейки) положительна и превышает примерно 0,1 В. Если потенциал ячейки находится в интервале от +0,1 до -0,1 В, то между реагирующими веществами устанавливается равновесие, причем в реакционном объеме все они присутствуют в заметных количествах. Если же потенциал ячейки ниже -0,1 В, то реакция, по существу, не идет. Однако если полоску цинка погрузить в раствор, содержащий ион меди, будет протекать реакция
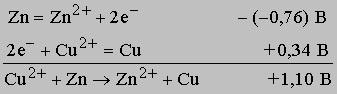
Поскольку потенциал представляет собой большую положительную величину, реакция идет до конца. Если же полоску меди поместить в раствор, содержащий ион цинка, то реакция Cu + Zn2+ -> Cu2+ + Zn не произойдет из-за высокого отрицательного потенциала ячейки (-1,10 В). Если смешать растворы, содержащие бихромат-ион и ион марганца(II), то между реагентами и продуктами установится равновесие, при этом оба иона и продукты реакции - оксид марганца(II) и ион хрома(III) - будут присутствовать в достаточно большой концентрации, поскольку потенциал этой реакции при стандартных условиях составляет лишь 0,1 В.
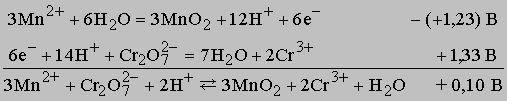
Отметим, что правая и левая части уравнения первой полуреакции умножены на три, чтобы получить число электронов, необходимое для второй полуреакции. Величина потенциала от этого не изменяется. В обеих частях суммарного уравнения должно быть одинаково не только число атомов каждого типа, но и суммарный электрический заряд (в данном случае он равен +6). В отличие от электролитической ячейки, во внешнюю цепь которой включен источник тока, гальванический элемент сам вырабатывает электричество. Гальваническими элементами являются, например, свинцовый автомобильный аккумулятор и батарейка для карманного фонарика. Напряжение, которое дает элемент, определяется потенциалами протекающих в нем полуреакций. Реакции с перераспределением обобществленных электронов. Приведем несколько примеров таких реакций:
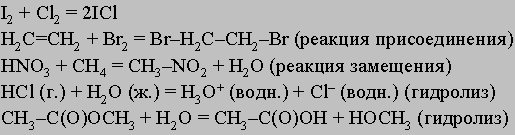
Более подробное обсуждение реакций с участием неорганических и органических соединений можно найти в статье